熒光探針定量PCR技術原理及應用
熒光探針定量PCR技術原理及應用
PCR技術是通過對基因的選擇性片段進行體外高效擴增,實現目的基因的檢測。熒光探針定量PCR(FQ-PCR)是一種新的基因定量檢測技術,國外文獻多用“實時定量PCR(real time quantitative PCR)”或“TaqMan PCR(以美國PE公司商標命名) ”。該技術是在常規PCR基礎上加入熒光標記探針,巧妙地把核酸擴增(PCR)、雜交及光譜技術結合在一起,從而實現了對目的基因的準確定量檢測,正發展成為臨床實驗診斷的常規技術。
1.原理
FQ-PCR的工作原理[1-3]是利用Taq酶的5’ → 3’外切酶活性,在PCR反應系統中加入一個熒光標記的探針。該探針可與引物包含序列內的DNA模板發生特異性雜交,探針的5’端標以熒光報告基團FAM(6-羧基熒光素,熒光發射峰值在518mm處),靠近3’端標以熒光淬滅基團TAMRA(6-羧基四甲基諾丹明,熒光發射峰值在582nm處),兩者之間構成能量傳遞結構。當探針保持完整時,5’端熒光報告基團所激發出的熒光信號被3’端淬滅基因吸收或抑制,不出現熒光信號變化。當PCR反應體系中有目的基因存在,就會擴增出特異核酸片段,熒光探針即會根據堿基配對的原理與之雜交。當PCR進入延伸(復制)期,Tap酶從引物3’端開始,隨新鏈延伸沿DNA模板移動,當移動到探針結合的位置時,其5’→ 3’端外切酶活性作用,將探針切斷(切口平移效應)。熒光報告基團和淬滅基團間的能量傳遞結構被破壞,淬滅基團的淬滅作用被解除,熒光報告基團的熒光信號釋放出來(圖1)。PCR反應每復制一個特異核酸片段,就有一個探針被切斷,伴隨一個熒光信號的釋放。由于被釋放的熒光基團數目和PRC產物是一對一的關系,因此用熒光檢測技術檢測出的熒光信號有無或強弱,即代表擴增產物有無或多少。由于熒光信號是代表擴增產物的有效特異信號,無需進行有效和無效信號分離,實現了儀器實時檢測(圖2),為新的PCR定量原理創造了條件。
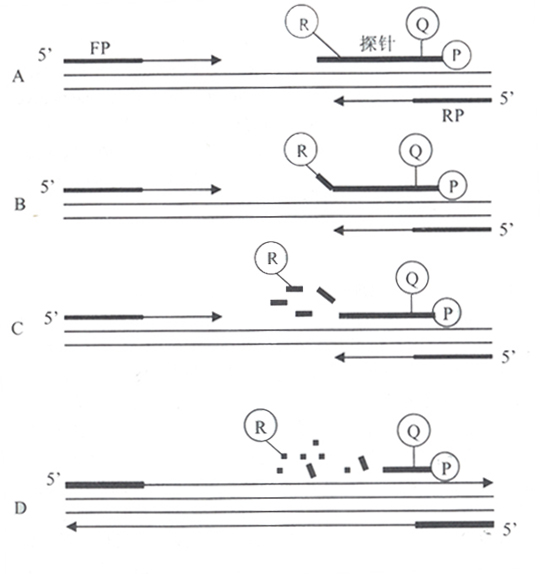
圖1.TaqMan PCR反應模式
(A)聚合反應:(B)鏈置換;(C)裂解;
(D)聚合完成(R:FAM;Q:TAMRA;FP:上游引物;RP:下游引物)
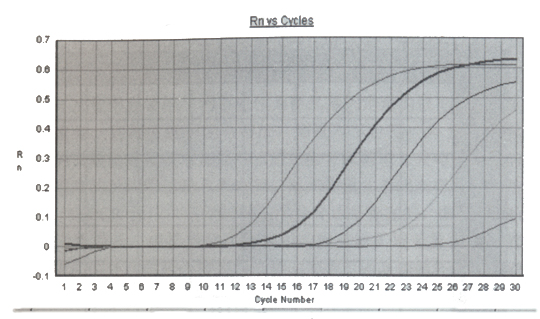
圖2.FQ-PCR實時動力學曲線
ABI公司首先根據上述原理研制了ABI 7700 等系列定量PCR儀,在PCR反應中設置標準模板系列(一般5~7個標準濃度)反應管和空白對照管。通過實時檢測反應管中的熒光信號,計算出RQ+、RQ-、△RQ。RQ+代表樣品管熒光報告基團發光強度與淬滅基團發光強度的比率,RQ-代表空白管中二者的比率,△RQ(△RQ = RQ+-RQ-)代表PCR過程中熒光信號變化量。當熒光信號增強到某一閾值(根據熒光信號基線的平均值和標準差,計算出以99.7%的置信度大于平均值作為閾值)時,標準模板反應管所用的循環次數(Ct值)就被記錄下來。Ct值與標準模板數量的對數值之間有嚴格的線性關系[3],利用系列標準模板的Ct值,制成標準曲線(圖3),根據待測樣品的Ct值,就可在標準曲線中確定待測樣品起始的DNA數量。根據數據處理,即可得出定量結果。探針設計一般應符合以下條件[2]:①探針長度應在20~40個堿基左右,以保證結合的特異性。②GC堿基含量在40%~60%,避免單核苷酸序列的重復。③避免與引物發生雜交或重疊。④探針與模板結合的穩定程度要大于引物與模板結合的穩定程度,因此探針的Tm值要比引物的Tm值至少高出5℃。另外,探針的濃度,探針與模板序列的同源性,探針與引物的距離都對實驗結果有影響。
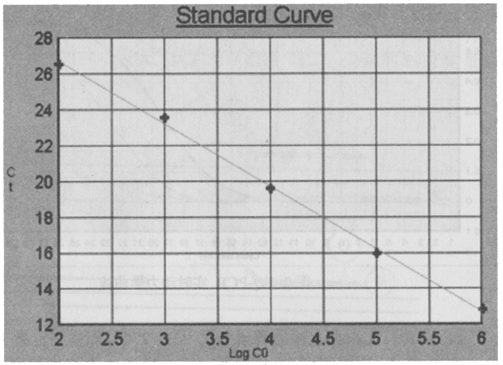
圖3.FQ-PCR 標準曲線
2. 技術特點
2.1 封閉狀態下檢測,避免了擴增產物污染而致的假陽性
傳統PCR于反應結束后取出反應液,通過電泳染色和紫外儀觀察結果。擴增產物在開放狀態下分析,對實險室的污染是不可避免的。因污染而導致假陽性,成為PCR臨床實驗診斷技術應用一個難以逾越的障礙。FQ-PCR在全封閉狀態下實現PCR擴增和產物分析,完全杜絕了擴增產物污染而導致的假陽性。至于樣品間的污染,無論從目的基因的數量、濃度還是顆粒大小分析,都比較容易控制。我國PCR臨床應用出現問題,產物污染所致假陽性是主要原因之一。
2.2 基因的定量檢測,擴展了臨床應用空間
傳統PCR對基因的檢測只能定性,不能定量主要是由擴增產物積累的動力學所決定的:①PCR產物在擴增過程中呈指數積累,當產物增加到一定程度,產物就停止了指數積累。不同起始模板,其指數增長期所用的循環是不同的,因此,不同數量基因的樣品在同一循環次數中積累的產物不能作為樣品基因定量的依據;②PCR產物積累到一定程度就不能再增加,再進入平臺期。為了擴大PCR檢出的靈敏度通常要增加循環次數,循環次數增加使得樣品目的基因含量高的反應管已進入平臺期,終產物量并不代表樣品目的基因含量;③PCR反應的管間擴增效率差異總是存在的,既然PCR產物呈指數增長,由擴增效率差異引起的產物擴增差異也呈指數積累,增加循環次數勢必增加終產物的差異,而減少循環次數又降低了檢測的靈敏度。FQ-PCR采用實時檢測,使所有含有不同數量的目的基因均在同一條件(達到熒光閾值)下進行分析,因而更具有可比性。而且,這一條件處于擴增產物指數積累初期,合成產物所需的dNTP、酶、離子均處于飽和的最佳狀態,所以FQ-PCR循環參數與起始模板間有良好的線性關系(相關系數>0.95),實現了極為精確的基因定量檢測。
2.3 光譜技術進一步提高了靈敏度
FQ-PCR 技術已用于單細胞基因診斷,靈敏度已達到極限水平,即檢測單拷貝基因,而傳統PCR是不易做到的。靈敏度提高得益于光譜技術。
2.4 熒光探針雜交,進一步提高了特異性
PCR 擴增中常會出現非特異性擴增和引物二聚體,從而影響了對特異電泳帶的判斷。FQ-PCR通過特異性探針雜交信號檢測PCR擴增產物,相當于PCR反應過程中自動完成了Southern雜交,進一步提高目的基因檢測的特異性。
2.5 擴增與自動分析一體化,檢測更加簡便和快速
FQ-PCR通過計算機和分析軟件,使PCR擴增、產物檢測和定量分析一體化,比傳統定性PCR更為簡便和快速,同時也避免了傳統PCR產物分析中有害物質對人體的影響,計算和數據處理也有利于科研和臨床資料的保存和分析。
3. 臨床應用概要
科學研究已經證明,人類疾病大都直接或間接與基因有關,臨床實驗醫學正進入基因診斷時代。但對于許多疾病的發生和發展來說,相關基因不是有無問題,而是一個從量變到質變的過程,基因定量檢測更具有臨床意義。
3.1 感染性疾病
PCR在醫學檢驗學中最有價值的應用領域就是對感染性疾病的診斷。理論上,只要樣本有一個病原體存在,PCR就可以檢測到。一般實驗室也能檢出10~102基因拷貝,而目前病原體抗原檢測方法一般需要105-7個病原體才可檢測到。PCR對病原體的檢測解決了免疫學檢測的“窗口期”問題,可判斷疾病是否處于隱性或亞臨床狀態。
定量PCR研究資料已表明,病原體數量與感染性疾病病情的輕重程度、傳染性及治療效果均有相關性。許多研究表明,人類免疫缺陷病毒(HIV)感染后,潛伏期長短和臨床癥狀輕重與血液中的病毒量顯著相關;有也研究表明,HIV病毒載量低于一定值時,沒有傳染性。
在乙型肝炎病毒、丙型肝炎病毒定量研究中發現,病毒的數量與某些藥物的療效相關。例如,干擾素治療對肝炎病毒高拷貝者不敏感,低拷貝者敏感;而有些藥物則具有顯著降低病毒高拷貝的作
用。
3.2 腫瘤
盡管腫瘤發病的分子機制尚未完全清楚,但相關的基因的遺傳學改變的積累,是致癌性轉變的根本原因已被普遍接受。
癌基因的表達增加和突變,在許多腫瘤早期和良性的階段就可出現。PCR技術不但能有效的檢測基因的突變,而且能準確檢測癌基因的表達量,可據此進行腫瘤早期診斷、分型、分期和預后判斷。
幾乎所有慢性骨髓性白血病患者都可檢測到原癌基因易位導致的BCR/ABL融合基因形成,定量PCR技術可通過檢測BCR/ABL融合基因的表達確定微量殘余惡性細胞存在的數量,以此作為治療效果和估計復發的危險性的依據。
腫瘤標記物質也是腫瘤診斷的熱門研究領域。目前臨床對此多用免疫學方法檢測,靈敏度低,一般需要達到108個分子數。用定量逆轉錄(RT)-PCR方法,一般條件下可檢出10-102某種標志物的mRNA,可大大提高檢出率。
一些病毒致癌作用也與病毒載量有關,EB病毒載量的FQ-PCR檢測結果已被用于鼻咽癌早期發現和隨訪。
3.3 遺傳病
PCR技術首次臨床應用就是從檢測鐮狀細胞和β-地中海貧血的基因突變開始的。基因的突變和缺失均會引起各種珠蛋白的表達不平衡,用FQ-PCR檢測各種珠蛋白基因表達差異,是地中海貧血診斷的有效手段。
總之,除與疾病直接相關的基因檢測外,各種與疾病相關的細胞因子、激素、受體,用FQ-PCR方法檢測其基因表達水平具有更高的靈敏性,更有利于疾病診斷。
參考文獻
[1] Liva K J, Flood SJA, Marmaro J, et al. Oligonucletides with fluorescent dyes at
opposite ends provide a quenched prode system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Applic, 1995,4:357-362.
[2] Holland PM, Abramson RD, Waston R, et al. Detection of specific polymerase chain reaction product by utilizing the 5′to 3′exonuclease activity of the
themus aquaticus DNA polymerase. Proc Nat Aca Sci USA,1991,88:7276-7280
[3] Higuchi R, Dollinger G, Walsh PS, et al. Stimutaneous amplification and
detection of specific DNA sequences. Biotechnology, 1992, 10:413-417.
廣州健侖生物科技有限公司病毒研究所
徐華
2014/03/05
- 上一篇:人與人之間接觸不會傳播登革熱(圖) 2014/9/29
- 下一篇:廣東省登革熱病例總數已達到10743例 死亡3例 2014/9/29
